חור זעיר – בשורה גדולה
חוקרים בפקולטה להנדסה ביו-רפואית פיתחו בדיקה מהירה ומדויקת לנוכחות נגיף Covid-19, המייתרת את השימוש בהגברת PCR
חוקרים בטכניון פיתחו שיטה חדשנית, בעלת דיוק גבוה, לאבחון קורונה ללא צורך בהגברת PCR. בשיטה זו מזוהה נוכחותו של נגיף SARS-CoV-2 בדגימה על סמך ספירה וכימות של מולקולות אר-אן-איי בודדות.
את המחקר שהתפרסם בכתב העת ACS Nano הובילו פרופ' עמית מלר והפוסט-דוקטורנטית ד"ר יאנה רוזבסקי והשתתפו בו ד"ר טל גלבוע, ד"ר קסנדר ון קוטן וד"ר דיאנה הוטנר – כולם חוקרים בפקולטה להנדסה ביו-רפואית בטכניון – ופרופ' אולריקה שטיין ממרכז מקס דלברוק לרפואה מולקולרית ומבית החולים שריטה בברלין.
בדיקת RT-qPCR, שהיא הבדיקה הנהוגה כיום באבחון Covid-19, מבוססת על שורה של שלבי הכנה ובהם איסוף הדגימה מהנבדק באמצעות מטוש, "פתיחה" של הנגיף כדי לחשוף את החומר הגנטי שבתוכו ומיצוי החומר הגנטי של האר-אן-איי. לאחר מכן מגיע שלב ה-RT, ובעברית "שעתוק לאחור", שבו מתורגמים רצפי האר-אן-איי לרצפי די-אן-איי, ואחריו שלב ה-PCR ("הגברה מעריכית") שמכפיל שוב ושוב את מולקולות הדי-אן-איי כדי להגיע לכמות המאפשרת דגימה שלהן בתמיסה וקביעה אם אכן מדובר בדי-אן-איי של SARS-CoV-2.
בדיקת RT-qPCR היא תהליך ממושך המצריך חומרים מיוחדים (ריאגנטים), ציוד מעבדה יקר ואנשי מקצוע מנוסים. יתר על כן, מחקרים שנערכו לאחרונה מעידים כי תוצאות הבדיקה עשויות להשתנות מיום ליום וכי בתהליך ההגברה המאסיבי עלולות להיווצר טעויות משמעותיות. זה הרקע למאמץ הכלל עולמי לפיתוח שיטות מהירות, זולות ומדויקות יותר. זהו אתגר מורכב מאוד כשלעצמו, והוא מורכב במיוחד כאשר מולקולות הנגיף מועטות ואינן תופסות חלק משמעותי בדגימה.
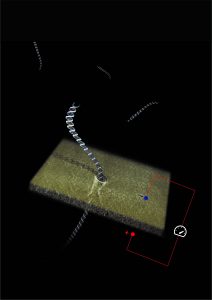
שיטת האבחון החדשנית שמציגה קבוצת המחקר של פרופ' מלר במאמר מבוססת על טכנולוגיה מקורית שהוא מפתח בעשור האחרון, טכנולוגיה שיעילותה כבר הודגמה בהקשרים רבים אחרים. מטרתה: single-molecule sensing, כלומר אבחון קליני על סמך אנליזה של מולקולות ביולוגיות בודדות, ללא צורך בדגימות גדולות המכילות העתקים רבים של אותה מולקולה. טכנולוגיה זו, שפותחה בין השאר לצורך אבחון תאי סרטן על סמך סמנים ביולוגיים, מבוססת על משיכת מולקולות ביולוגיות כגון די-אן-איי, באמצעות שדה חשמלי, לתוך חור ננומטרי המכיל חיישנים חשמליים או אופטיים. הפלט האלקטרוני עובר ניתוח חישובי המאפשר זיהוי וספירה ישירה ומיידית של המולקולות. גישה זו פותחת אפשרות למזעור מערכות החישה המולקולריות תוך שיפור הדיוק והאמינות של הבדיקות והרחבתן למקרים שבהם הגברת ה-PCR אינה יעילה או שהיא פוגעת במהימנות הבדיקה.
המאמר הנוכחי מציג יישומים של שיטה זו בשני הקשרים: איתור מולקולות אר-אן-איי המדווחות על היווצרות סרטן גרורתי ואבחון קורונה. בשני המקרים פיתחו החוקרים תהליך לפירוק אנזימטי של כל מולקולות הרקע מלבד מולקולות המטרה הרלוונטיות. בהקשר הראשון הדגימו החוקרים את פוטנציאל השיטה לטובת גילוי מוקדם של סרטן גרורתי, וזאת על ידי כימות עוצמת ההתבטאות של MACC1 – אחד הגנים החיוניים למעבר למצב גרורתי. הודות לרגישותה הרבה הצליחה הטכניקה החדשה לכמת את התבטאות הגן במדויק בתאים סרטניים מתחילת המחלה – אתגר שטכנולוגיות מבוססות PCR כשלו בו. למותר לציין שככל שהסמנים הגנטיים של מחלת הסרטן מתגלים בשלב מוקדם יותר, סיכויי הצלחת הטיפול גדלים מאוד.
בהקשר השני החוקרים כימתו באותה שיטה את מולקולות האר-אן-איי של נגיף SARS-CoV-2. השיטה המוצגת במאמר, RT-qNP, אינה השיטה הראשונה לאנליזה של מולקולה בודדת, אולם בניגוד לקודמותיה היא מייתרת תהליכים מקדימים המכניסים "רעש" וחוסר דיוק למערכת. שניים מתהליכים "מרעישים" אלה הם טיהור הדגימה, המוביל לאובדן של רוב הסמנים הביולוגיים המשמעותיים, והגברה של מולקולות הדי-אן-איי המובילה כאמור לשגיאות ולאבחון שגוי.
לדברי פרופ' מלר, "השיטה שלנו מאפשרת חישה כמותית של הביטוי הגנטי של המולקולה באמצעות התקן מבוסס ננו-חיישנים פשוט יחסית, ללא צורך בטיהור הדגימה וללא צורך בהגברה – תהליכים הפוגעים ברגישות הבדיקה ובמהימנותה. כפי שהראינו, הטכנולוגיה שלנו משמרת במשך כל התהליך את רמת הביטוי הגנטי של מולקולות האר-אן-איי המקוריות. כך מושגת אנליזה מדויקת יותר, החיונית בשני ההקשרים הנדונים – סרטן גרורתי ונגיף SARS-CoV-2."
עבור קבוצת המחקר של פרופ' מלר, המאמר הנוכחי הוא ציון דרך חשוב מאוד אולם אינו סוף פסוק. מערכת החישה המבוססת ננו-חרירים עתידה להפוך להתקן נייד ולייתר את השימוש בציוד מעבדתי מסורבל. המחקר ממשיך לאפיקים טכנולוגיים וקליניים בפקולטה להנדסה ביו-רפואית בטכניון תוך שיתוף פעולה עם בנק הדגימות (biobank) בקריה הרפואית רמב"ם. בה בעת נעשים צעדים למסחור הטכנולוגיה כדי להביאה בהקדם האפשרי לשימוש רחב.
המחקר נתמך על ידי האיחוד האירופי (מענק ERC במסגרת תוכנית Horizon 2020 של הנציבות האירופית למחקר באיחוד האירופי), קרן המדע הלאומית (ISF) ותוכנית SignGene התומכת במשתלמים לדוקטורט.
למאמר במגזין ACS NANO לחצו כאן
- התקן זעיר מבוסס ננו-חרירים לגילוי מולקולות ביולוגיות בודדות
- איור של מולקולות די-אן-איי כשהן עוברות בזו אחר זו דרך ננו-חריר
- התקן הננו-תעלות, המשמש למתיחת גדילי די-אן-איי ארוכים
כל הזכויות שמורות © הפקולטה להנדסה ביו-רפואית 2019 עיצוב ע"י כתום בניית אתרים | שיווק באינטרנט